# 背景介绍 #
2021.10.14,欧盟颁布了医疗器械新法规IVDR延期的草案,2017/746/EU IVDR 法规原文第110条(过渡性条款)中规定了低风险器械的过渡期,该草案修正了该过渡期,数量众多的低风险等级器械将会有更长的过渡期,并且,由发证机构介入发证的IVD产品的过渡期将会延长到2025年5月26日。
该草案依据产品风险分类不同,执行逐步新旧法规转换,需要转换IVDR的时间,都分别延长如下:
IVDR Class D类产品:2025年5月26日
IVDR Class C类产品:2026年5月26日
IVDR Class B类产品:2027年5月26日
IVDR Class A类产品(灭菌类):2027年5月26日
对于IVDR的延期,原因还是显而易见的,目前公告机构负荷不足,贸然执行IVDR会引发大面积的体外诊断产品断供。
所以对于IVD生产商而言,在2022年5月26日前完成注册,可以按照现行的IVDD指令下的other分类进行注册无论从时间和性价比上而言无疑是好的选择。
我们可以通过以下的比对表格来进行直观的解读和判断:
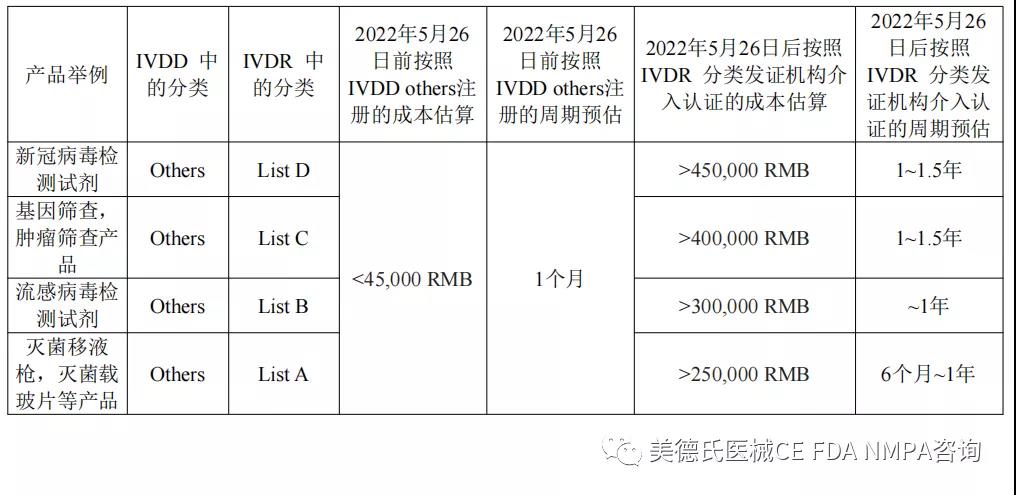
法规优惠政策即将截止, IVDD others分类的众多产品,尽快准备完备的CE技术文档,进行欧盟备案注册,以尽量争取过渡期!
bv1946伟德械提供IVDD-Other类产品技术文件编写和欧盟注册服务!
详情请联:
Kevin Chen 139 1610 9895
(微信同号)
Jerry Song 137 6103 5974
(微信同号)