# 背景介绍 #
2022.01.25,欧洲议会和欧盟委员会发布REGULATION (EU) 2022/112,确定了IVDR 过渡期延期事宜。
依据发布的REGULATION (EU) 2022/112,执行逐步新旧法规转换,需要转换IVDR的时间,都分别延长如下:
IVDR Class D类产品:2025年5月26日
IVDR Class C类产品:2026年5月26日
IVDR Class B类产品:2027年5月26日
IVDR Class A类产品:2027年5月26日
对于IVDR的延期,原因还是显而易见的,目前公告机构负荷不足,贸然执行IVDR会引发大面积的体外诊断产品断供。
所以对于IVD生产商而言,在2022年5月26日前完成注册,可以按照现行的IVDD指令下的other分类进行注册无论从时间和性价比上而言无疑是极优选择。
我们可以通过以下的比对表格来进行直观的解读和判断:
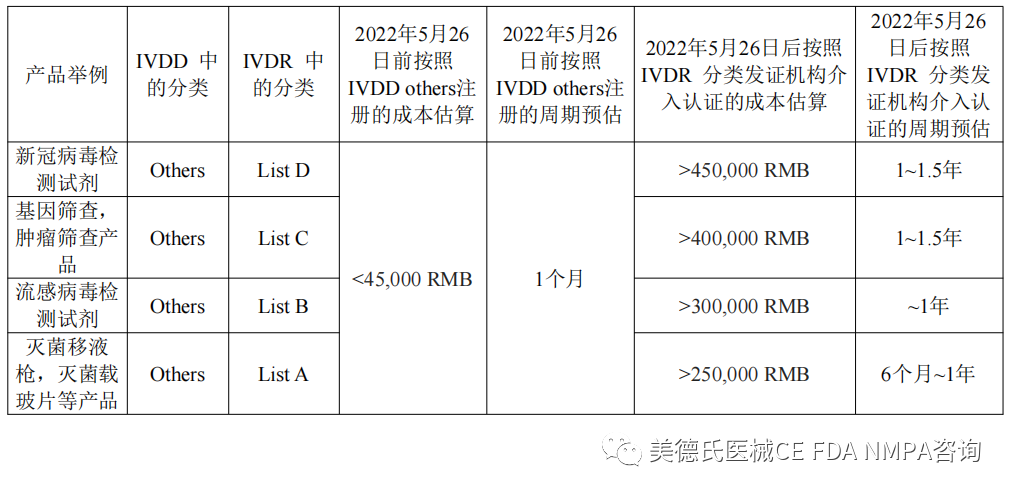
截至今日,临2022年05月26日这个时间节点已经只有60天的时间
欧盟IVDD others产品注册截止期临近!
IVDD生产商务必抓住这一波法规优惠政策的机会!
bv1946伟德械提供IVDD-Other类产品技术文件编写和欧盟注册服务!
详情请联:
Kevin Chen 139 1610 9895
(微信同号)
Jerry Song 137 6103 5974
(微信同号)
King Yan 135 6401 2424
(微信同号)
bv1946伟德械服务范围
质量管理体系服务
| 服务 | 内容 |
| ISO13485 | ISO 13485的质量体系的培训、建立及运行辅导 |
| FDA | FDA CFR820 的质量体系的培训、建立及运行辅导 |
| MDSAP | MDSAP的质量体系的培训、建立及运行辅导 |
| NMPA | NMPA(GMP、GSP)的质量体系的培训、建立及运行辅导 |
| 质量体系日常维护服务 | FDA820的不符合项以及警告信、欧盟的CAPA、流程改进、质量体系维护的外包、供应商审核 |
法规合规及产品注册服务
| 服务 | 内容 |
| 欧盟市场准入整体解决方案 | 包括CE技术文档撰写、辅导、测试、认证全套方案。还包括欧代服务、欧盟FSC、ISO14971 风险分析、临床评价、软件周期、可用性等欧盟合规的咨询与服务 |
| 美国市场准入整体解决方案 | 包括510K文档撰写与认证,产品列名、工厂注册、美国代理人、UDI的合规咨询与服务 |
| 中国市场准入整体解决方案 | 包括NMPA文档撰写与注册,生产许可证、中国FSC、医疗器械广告审核的合规咨询与服务 |
| 其他国家的认证注册咨询服务 | 包括全球法规注册咨询服务,如澳大利亚、新西兰、加拿大、巴西、俄罗斯、日本、韩国等全球国家的注册咨询服务 |
医疗器械法规培训
| 服务 | 内容 |
| 国内外法规培训精讲 | MDR 2017/745/EU 法规培训 |
| IVDR 2017/746/EU 法规培训 | |
| MDR临床实验方案设计培训 | |
| IVDR临床实验,性能实验方案设计培训 | |
| ISO14971-2019 医疗器械风险管理培训 | |
| 《ISO13485-2016医疗器械 质量管理体系用于法规的要求》深度解读 | |
| 产品设计开发,产品可用性工程培训 | |
| ISO 11135 11137 培训 | |
| 其他定制式企业培训 |