为什么无法录入UDI-DI?
因为我们登录Eudamed 的数据库的账号不对哦!
Eudamed的数据库,我们通常有两个账号:LAA账号和LUA账号。这两个账号都是要求以不同的邮箱申请注册的。LUA账号要关联LAA账号,LUA账号输入相关的UDI信息后,LAA账号进行权限审批,批准通过后,UDI才会在Eudamed的数据库上显示。
可通俗理解为:LAA账号申请SRN,LUA账号录入UDI-DI。要先有LAA账号,才能注册到LUA账号!
两个账号的注册途径如下:
1.打开官网链接:https://webgate.ec.europa.eu/eudamed/landing-page#/
2.看到如下界面:
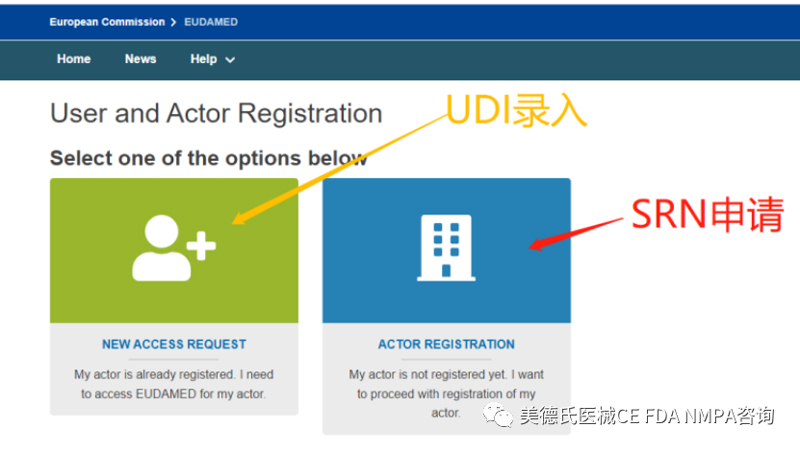
按要求注册好两个账号后,我们开始登录LUA账号,进行UDI-DI的录入。
登录后,我们进入到这个界面:点击“Register a new Basic UDI-DI”
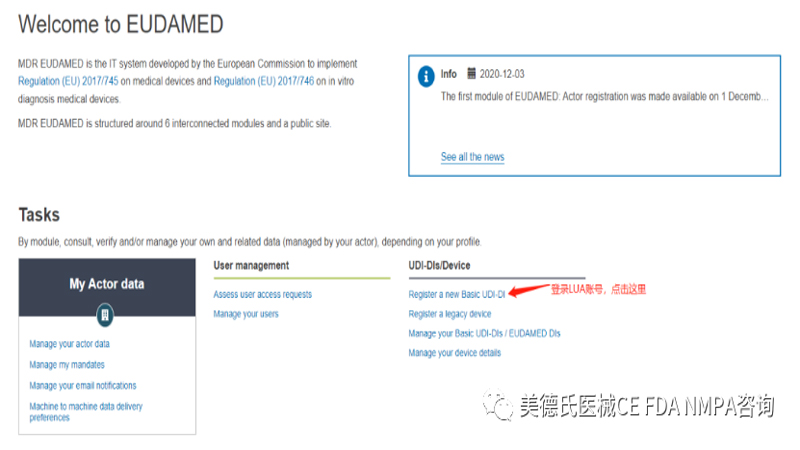
点击进入后,我们根据要求填写信息:
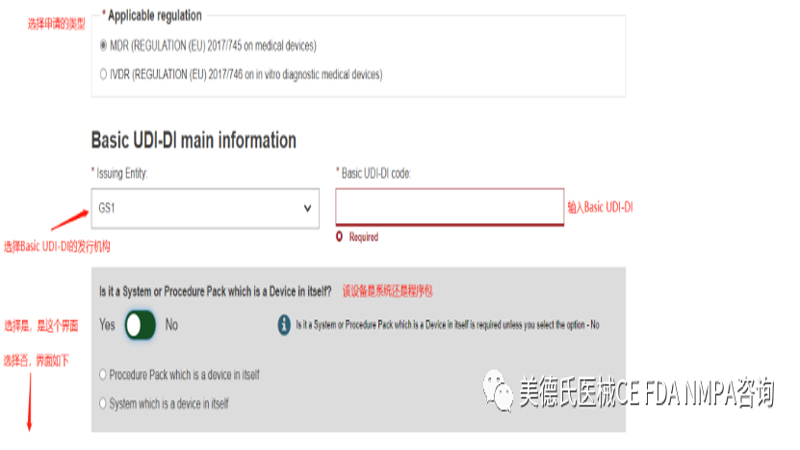
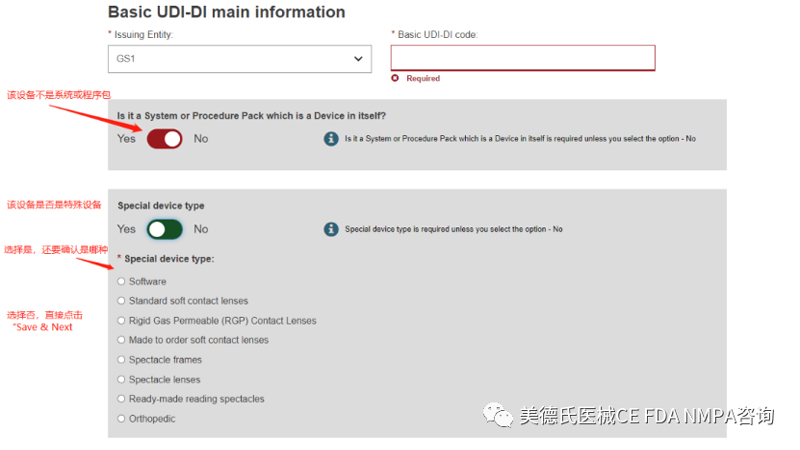
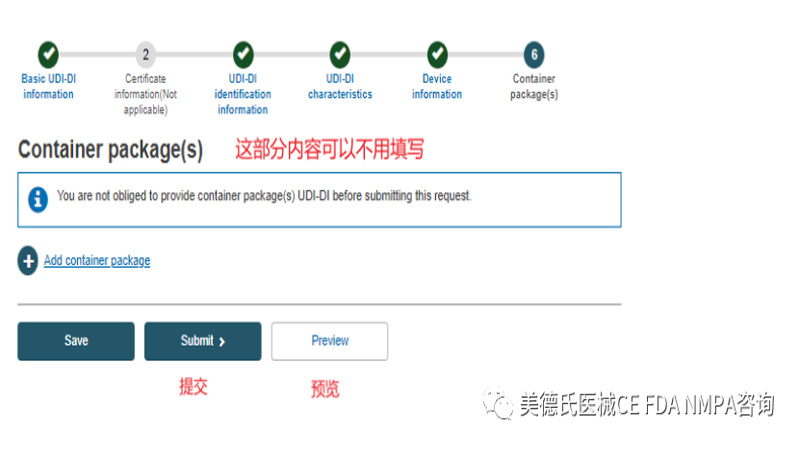
填写完这些基本信息后,我们正式进入UDI-DI的信息录入,一共有6步:
Step 1-Basic UDI-DI information:
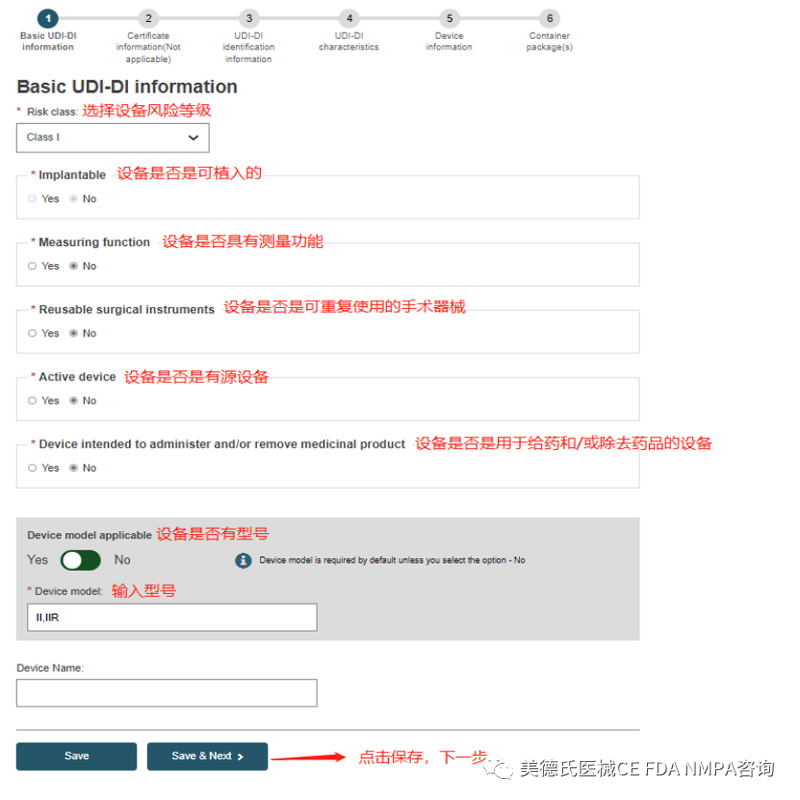
Step 2-Certificate information:
a.设备类型是Class I 和Class IIa的,Step2不用填写,直接跳到了Step3-UDI-DI identification information;
b.设备类型是Class IIb 和Class III的,Step2的 Certificate information 这里需要填写,填写的界面如下:
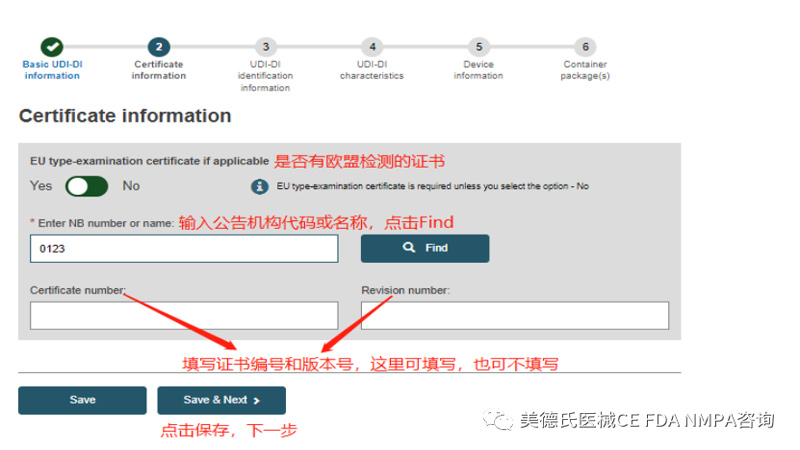
Step3-UDI-DI identification information:
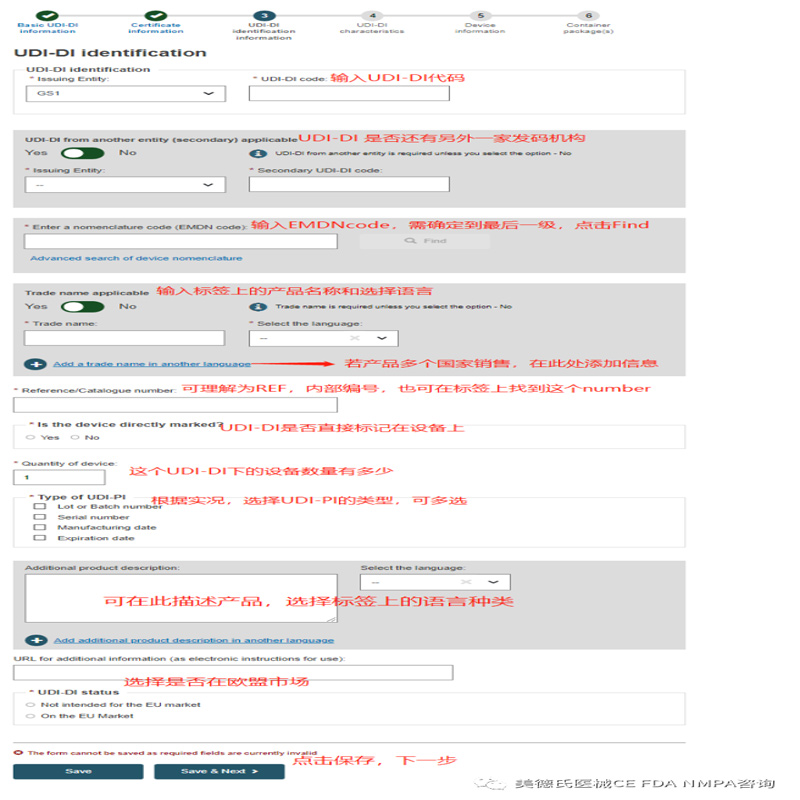
Step 4-UDI-DI characteristics:
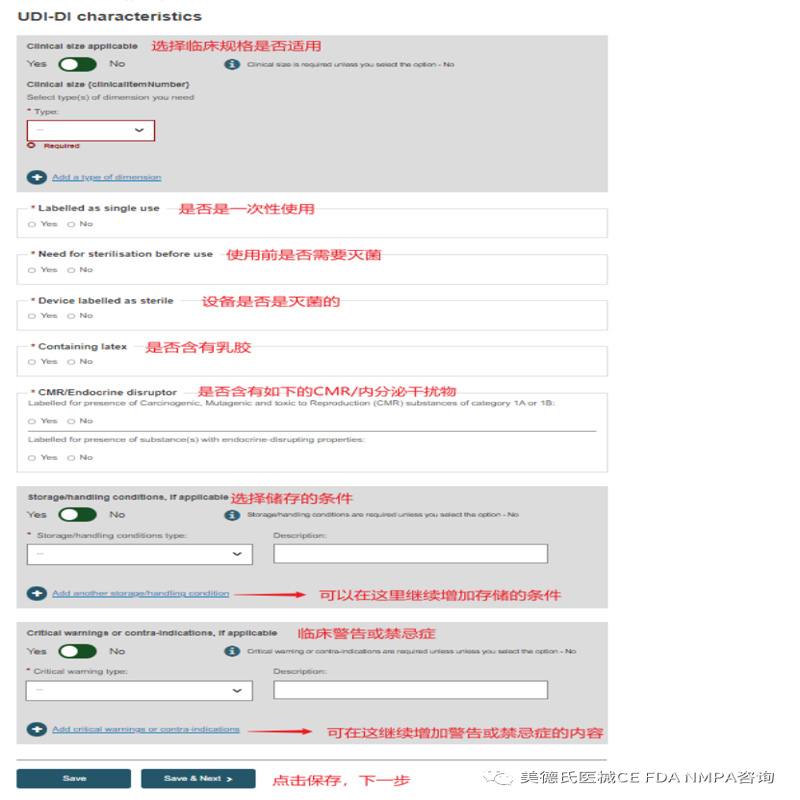
Step 5-Device information:
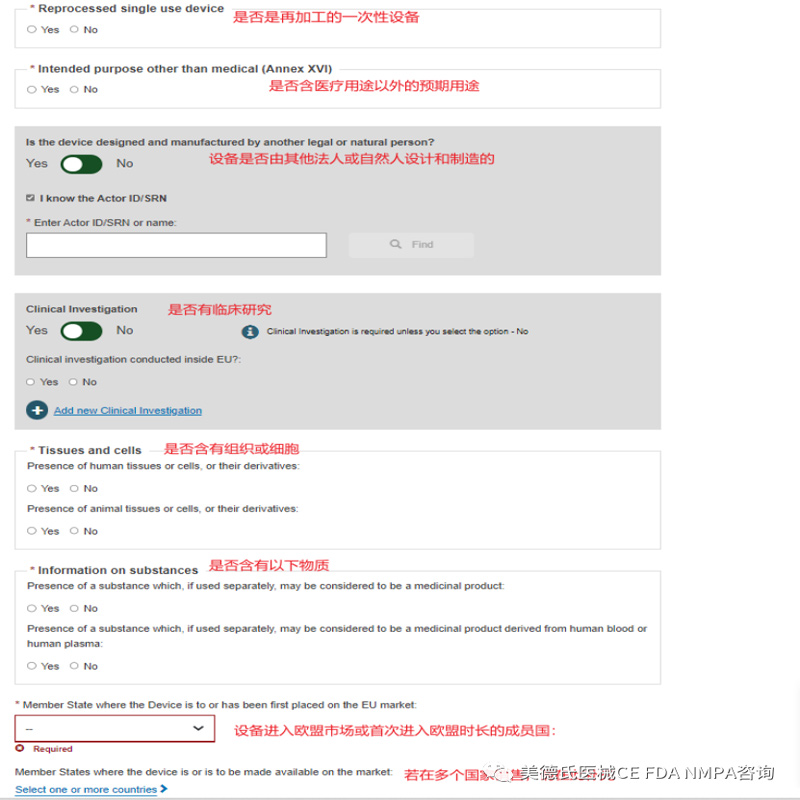
Step 6-Container package(s):
将弹出一个确认窗口,要求确认提交:

重新定位到一个新界面,说明已经提交成功!
 添加新的UDI-DI
添加新的UDI-DI
Basic UDI-DI可以对应不同的UDI-DI,那如何添加新的UDI-DI呢?
 请看以下步骤
请看以下步骤
1.在界面中点击“Manage your Basic UDI-DIs/EUDAMED DIs”:
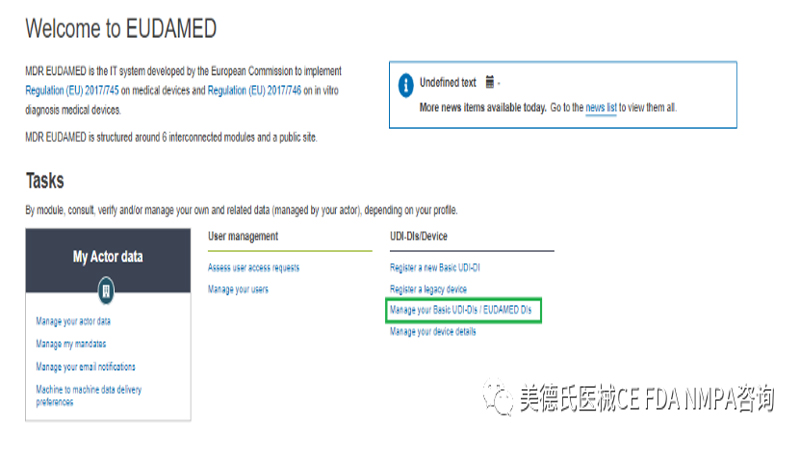
2.只能为已提交或已注册的Basic UDI-DI 添加新的UDI-DI:
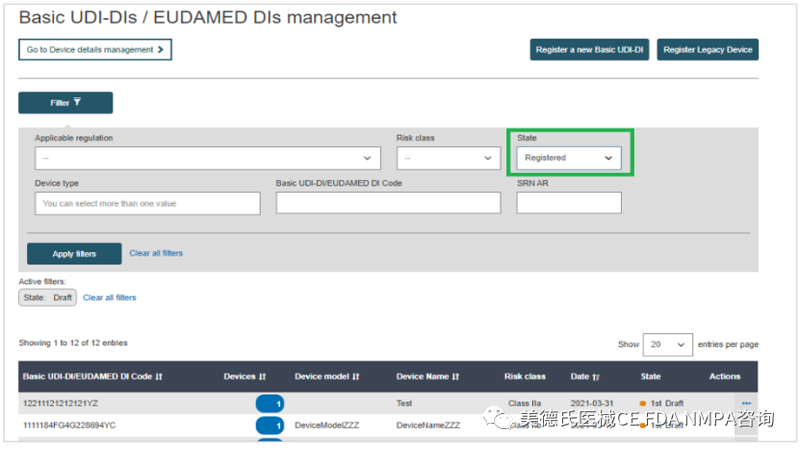
3.从结果中,找到要为其添加新的UDI-DI的Basic UDI-DI,单击右侧的三个点,点击“Add a new UDI-DI to this Basic UDI-DI:
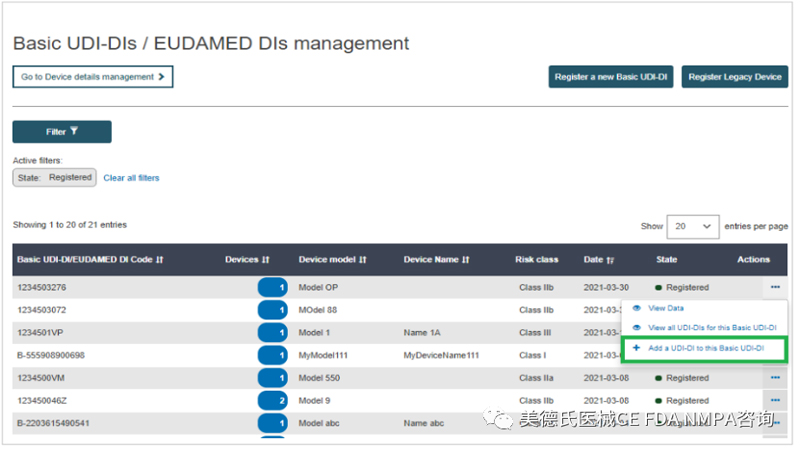
4.根据内容填写相关信息:
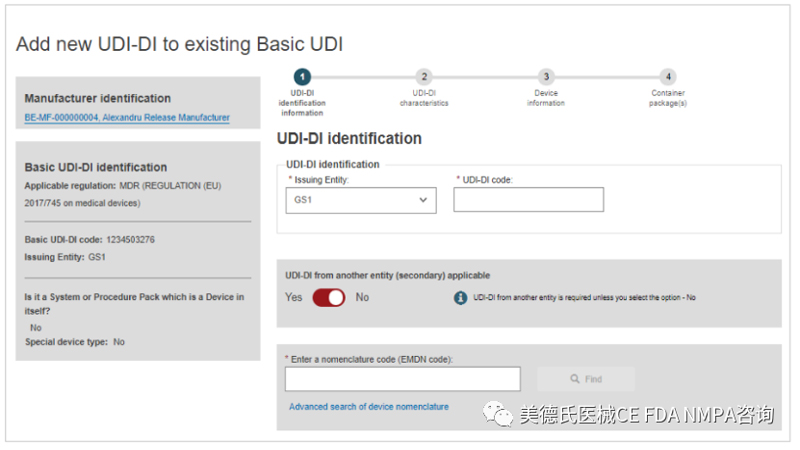
5.当完成以上的步骤后,请点击“Submit my request”提交。
bv1946伟德械服务范围
质量管理体系服务
服务 | 内容 |
| ISO13485 | ISO 13485的质量体系的培训、建立及运行辅导 |
| FDA | FDA CFR820 的质量体系的培训、建立及运行辅导 |
| MDSAP | MDSAP的质量体系的培训、建立及运行辅导 |
| NMPA | NMPA(GMP、GSP)的质量体系的培训、建立及运行辅导 |
| 质量体系日常维护服务 | FDA820的不符合项以及警告信、欧盟的CAPA、流程改进、质量体系维护的外包、供应商审核 |
法规合规及产品注册服务
| 服务 | 内容 |
| 欧盟市场准入整体解决方案 | 包括CE技术文档撰写、辅导、测试、认证全套方案。还包括欧代服务、欧盟FSC、ISO14971 风险分析、临床评价、灭菌、软件周期、可用性等欧盟合规的咨询与服务 |
| 美国市场准入整体解决方案 | 包括510K文档撰写与认证,产品列名、工厂注册、美国代理人、UDI的合规咨询与服务 |
| 中国市场准入整体解决方案 | 包括NMPA文档撰写与注册,生产许可证、中国FSC、医疗器械广告审核的合规咨询与服务 |
| 其他国家的认证注册咨询服务 | 包括全球法规注册咨询服务,如澳大利亚、新西兰、加拿大、巴西、俄罗斯、日本、韩国等全球国家的注册咨询服务 |
医疗器械法规培训及测试,临床实验服务
服务 | 内容 |
| 国内外法规培训及测试,临床实验服务 | MDR 2017/745/EU 法规培训 |
| IVDR 2017/746/EU 法规培训 | |
| MDR临床实验方案设计及临床实验服务 | |
| IVDR临床实验,性能实验方案设计及实验服务 | |
| ISO14971-2019 医疗器械风险管理培训 | |
| 《ISO13485-2016医疗器械 质量管理体系用于法规的要求》深度解读 | |
| 产品设计开发,产品可用性工程培训 | |
| ISO 11135 11137 灭菌培训 | |
| 其他定制式企业培训 |